我國開放mRNA疫苗提供青少年及兒童施打,但有家長擔憂副作用可能高於蛋白質次單位疫苗,盼政府加速審查高端12至17歲的新冠疫苗EUA,若成功將可提供更多元疫苗選擇。
我國疫情正值「高原期」,截至6月7日,確診累計人數約為243萬人,統計至6月2日,○歲至19歲確診43萬人,中重症累計139人、死亡13人,接種疫苗能提高其保護力。
不過,國內目前開放5到17歲族群施打的疫苗限莫德納及BNT,均屬mRNA疫苗,不少家長擔心,有產生心肌炎等副作用之風險且影響兒童發育,盼政府開放蛋白質次單位疫苗,讓選擇更多元。
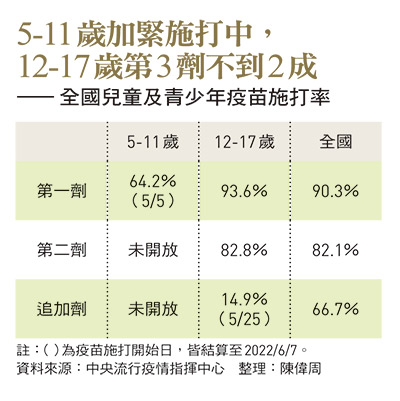
家長的擔心也反映在數據上,據中央流行疫情指揮中心統計,12至17歲青少年族群,第一劑施打率為93.6%、第二劑82.8%,第三劑追加劑開放兩周施打率為14.9%,同時間,全國第三劑施打率來到66.7%。但5至11歲兒童從5月開放施打迄今,第一劑施打率只達64.2%。不少家長直言,「寧可在家不出門,也不敢讓孩子打疫苗。」
家長擔憂併發心肌炎〉
應審核蛋白質次單位疫苗
對於mRNA疫苗的疑慮,指揮中心於官網公布的兒童接種新冠疫苗QA裡寫到,莫德納、BNT可能產生副作用為發燒、疲勞及頭痛等,但嚴重副作用例如心肌炎、心包膜炎則「相對罕見」,發生機率小於1萬分之1。
至於mRNA疫苗是否對兒童產生永久性傷害、長期副作用?指揮中心說,「mRNA疫苗是一種新的疫苗,因此接種數年或更長時間後,對健康的影響尚待觀察。」
值得注意的是,3月17日,林口長庚醫院發表國內第一份COVID-19疫苗追加劑接種研究成果,指出「發現不論是使用哪一種廠牌的疫苗當追加劑,皆可有效提升受試者體內抗體生成效果,也更能有效對抗Omicron變種病毒。而施打後的副作用,則以莫德納比率最高,高端比率最低。」
上述研究成果雖是針對成人進行,但台灣疫苗推動協會理事長、林口長庚兒童感染科教授級主治醫師黃玉成認為,Novavax及高端屬傳統蛋白質次單位疫苗,安全性相較mRNA疫苗高,認為食藥署應盡速審查開放,讓家長及兒童多一種選擇。
3月10日,指揮中心專家小組成員李秉穎上廣播節目透露,「食藥署未讓高端通過12至18歲施打,理由是『不能橋接再橋接』,國內肺炎鏈球菌疫苗也使用再橋接。」李秉穎認為,食藥署不核發高端青少年緊急授權EUA是沒有道理的。對此,食藥署長吳秀梅對外指出,「需要高端提供更多技術性資料來佐證。」強調全案正審查中,不方便對外說明,並沒有不給核准。
食藥署的擔憂也有其依據,因為新冠疫苗取得各國的EUA,均依臨床試驗數據成果,沒有「橋接再橋接」的先例。黃玉成認為,雖然沒有先例,但過去開發HPV(人類乳突病毒)疫苗也是用相同的技術研發通過。「食藥署太嚴格。」他認為,高端疫苗算是從全球新冠疫苗中竄起的新秀,政府應適時協助。
美政府、學界助研究〉
台灣應借鏡化阻力成助力
反觀與高端同屬於蛋白質次單位疫苗的Novavax,命運卻不同。Novavax今年2月10日公布12至17歲青少年第三期試驗數據,疫苗保護力為82%。4月14日,Novavax宣布針對該青少年族群,評估第三劑安全性與免疫性,該試驗正是在美國政府的支持下進行,由國防部、生物醫學高級研究與發展局提供17.5億美元,預計在今年下半年取得研究成果。
美國經驗值得政府關注,新冠肺炎流行邁入第3年,各國都在研發疫苗,政府也投入資源協助,高端在這一波疫苗熱潮中脫穎而出,還在WHO納入團體試驗疫苗,進行第三期臨床試驗,若臨床試驗通過,取得WHO認可的機會將大增。食藥署除了嚴格把關EUA,更應積極協助業者,讓國內更多青少年、兒童族群多一個疫苗選擇。
醫師、公衛專家則提出兩大建議供政府參考。首先是資金協助,黃玉成認為,高端做傳統三期試驗,必須去海外收案,每個個案要價1萬美元,還有複雜的外交問題,必須仰賴政府的幫忙。
再者,台大公共衛生學院教授陳秀熙建議,指揮中心應成立生技平台,結合學界、中研院、各醫學大學資源協助開發,未來不論疫苗、快篩等防疫相關臨床研究,都可以促成合作,高端也可透過該平台獲得協助。
6月1日,美國疾病管制與預防中心(CDC)發布聲明,對於患有慢性病的兒童(包含肥胖、免疫力差及糖尿病等),保護家人的最佳方式就是「接種新冠疫苗」,未來將陸續批准5歲以下的兒童接種疫苗。
陳秀熙指出,雖然接種mRNA疫苗對兒童及青少年的長期影響,短時間尚未有明確的科學證據(佐證),但台灣正值疫情高原期,兒童、青少年接種疫苗提升保護力的「利大於弊」,可降低重症、住院率及死亡率等。他建議兒童、青少年等族群至少先接種兩劑基礎劑,等未來高端通過青少年EUA之後,才有機會成為加強劑的選擇。
隨著台灣疫情升溫,接種疫苗提高保護力,已成為防疫關鍵,政府應協助Novavax與高端的EUA審核,若有機會爭取更多兒童疫苗,將能降低家長疑慮,並提供多元的疫苗選擇。











